LEYES DE LOS GASES IDEALES (1)
by Alison Apala
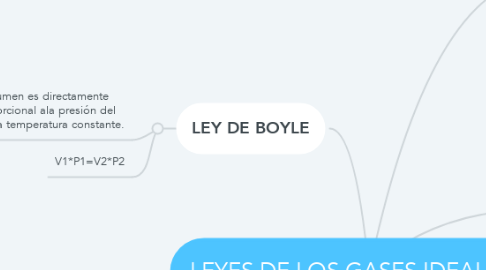
1. LEY DE BOYLE
1.1. El volumen es directamente proporcional ala presión del gas, a temperatura constante.
1.2. V1*P1=V2*P2
2. LEY DE AVOGADRO
2.1. Volúmenes iguales de todos los gases medidos a las mismas condiciones de temperatura y presión contienen el mismo número de moléculas.
2.2. V/n=K Se traduce en que si dividimos el volumen de un gas por el número de moles que lo conforman obtendremos un valor constante.
3. ECUACIÓN DE ESTADO
3.1. La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:
3.2. P*V = n*R*T
4. LEY DE DALTON
4.1. La presión total de una mezcla es igual a la suma de presiónes parciales que ejercen los de forma independiente
4.2. PT/nT=P1/n1=P2/n2=P3/n3
5. LEY DE GAY-LUSSAC
5.1. Si el volumen de un gas no cambia mientras lo calentamos, la presión del gas aumenta en la misma proporción en que se incrementa la temperatura
5.2. Esta ley se relaciona con el volumen, temperatura y presión. Al relacionarlos, dan origen a una constante: la masa del gas no varía.
5.3. P1/T1=P2/T2
6. LEY DE CHARLES
6.1. El volumen de la masa fija de un gas es directamente proporcional a la temperatura kelvin
6.2. V1/T1=V2/T2
7. LEY COMBINADA
7.1. V1*P1/T1= V2*P2/T2


