القوى بين الجزيئات
by mimi_ mimi

1. قوى التشتت
1.1. تسمى قوة ترابط بين جزيئات الاكسجين قوى التشتت وهي قوى تجاذب ضعيفة تنشأ بين الجزيئات غير القطبية
1.1.1. وتنتج هذه القوى الضعيفة عن إزاحة مؤقتة في كثافة الإلكترونات في السحب الإلكترونية
1.1.2. ثنائية قطبية مؤقتة
1.1.2.1. عندما يقترب جزيئان أحدهما من الأخر أو عند تصادمها-فإن السحب الإلكترونية ﻷحدهما تتنافر مع السحب الإلكترونية للجزيء الأخر، فتصبح كثافة الالكترونات حول كل نواة أكبر في الجهة من الاخرى، فيشكل كل جزيء ثنائية قطبية مؤقتة
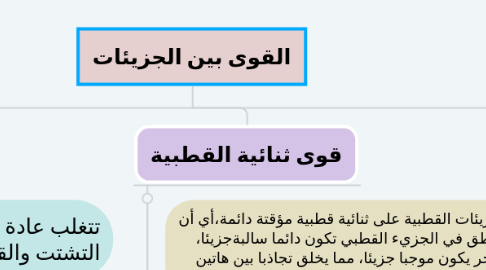
2. قوى ثنائية القطبية
2.1. تحتوي الجزيئات القطبية على ثنائية قطبية مؤقتة دائمة،أي أن بعض المناطق في الجزيء القطبي تكون دائما سالبةجزيئا، وبعضها الأخر يكون موجبا جزيئا، مما يخلق تجاذبا بين هاتين المنطقتين وهذا ما يسمى ثننائية قطبية
2.2. من المتوقع أن تكون قوى ثنائية القطبية للجزيئات الصغيرة أقوى من قوى التشتت، ومع ذلك فالكثير من الجزيئات القطبية تبقى قوى التشتت فيها أكبر من القوى الثنائية القطبية.
3. الرابطة الهيدروجينية
3.1. تتغلب عادة الروابط الهيدروجينية على كل من قوى التشتت والقوى الثنائية القطبية.
3.2. كيف تتكون الرابطة الهيدروجينية؟
3.3. لابد للهيدوجين أن يرتبط إما مع ذرة فلور أو أكسجين أو نيتروجين؛ حيث تكون كهروسالبية هذه الذرات كافية لجعل ذرة الهيدروجين ذات شحنة جزيئة موجبة
3.4. وتكون هذه الذرات في الوقت نفسه صغيرة بقدر كاف يسمح لأزواج الاكترونات غير الرابطة فيها بالاقتراب من ذرات الهدروجين.
3.4.1. الروابط الهيدروجينة بين جزيئات الماء أقوى من تجاذب الثنائية القطبية؛ ﻷن الرابطة بين الهيدروجين والأكسجين ذات قطبية كبيرة
