EREDU ATOMIKOAK
저자: Andrea Pérez

1. LEHEN EREDU ATOMIKOAK
2. THOMSONEN EREDUA: Thomsonek elektroia aurkitu zuen, egiaztatu egin zen elektroiak edozein substantziatan zeudela; Thomsonek atomoaren oinarrizko eredua sortu zuen, elektroi negatiboak xurgatuta zituen materia positiboa zeukana; baina eredu horrek ez zuen arrakastarik izan.
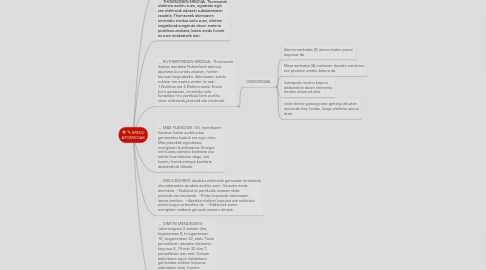
3. RUTHERFORDEN EREDUA: Thomsonek ikaslea izandako Rutherfordi atomoa apurtzea bururtatu zitzaion, horren barruari begiratzeko. Atomoaren eredu nuklear ere esaten zioten. bi zati: 1.Nukleoa eta 2.Elektroi-azala. Eredu horri garatzean, oinarrizko edo funtzesko hiru partikula berri aurkitu ziren: elektroiak,protoiak eta neutroiak.
3.1. ONDORIOAK;
3.1.1. Atomo-zenbakia (Z) atomo baten protoi kopurua da
3.1.2. Masa-zenbakia (A) nukleoan dauden neotroien eta protoien arteko batura da
3.1.3. Isotopoak neutroi kopuru desberdina duten elementu bereko atomoak dira.
3.1.4. Ioiak eletroi gutxiegi edo gehiegi dituzten atomoak dira; hortaz, karga elektriko purua dute
