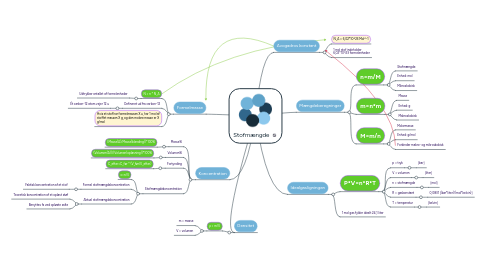
1. Koncentration
1.1. Masse%
1.1.1. (Masse(A)/Masse(blanding))*100%
1.2. Volumen%
1.2.1. (Volumen(A))/(Volumen(opløsning))*100%
1.3. Fortynding
1.3.1. C_efter=C_før * (V_før/V_efter)
1.4. Stofmængdekoncentration
1.4.1. c=n/V
1.4.2. Formel stofmængdekoncentration
1.4.2.1. Faktisk koncentration af et stof
1.4.3. Aktuel stofmængdekoncentration
1.4.3.1. Teoretisk koncentration af et opløst støf
1.4.3.2. Benyttes fx ved opløste salte
2. Formelmasse
2.1. N = n * N_A
2.1.1. Udtrykker antallet af formelenheder
2.2. Defineret ud fra carbon-12
2.2.1. Ét carbon-12 atom vejer 12 u
2.3. Hvis et stof har formelmassen X u, har 1 mol af stoffet massen X g, og den molare masse er X g/mol
3. Densitet
3.1. ρ = m/V
3.1.1. m = masse
3.1.2. V = volumen
4. Avogadros konstant
4.1. N_A = 6,02*10^23 Mol^-1
4.2. 1 mol stof indeholder 6,02*10^23 formelenheder
5. Mængdeberegninger
5.1. n=m/M
5.1.1. Stofmængde
5.1.2. Enhed: mol
5.1.3. Mikroskobisk
5.2. m=n*m
5.2.1. Masse
5.2.2. Enhed: g
5.2.3. Makroskobisk
5.3. M=m/n
5.3.1. Molarmasse
5.3.2. Enhed: g/mol
5.3.3. Forbinder makro- og mikroskobisk
6. Idealgasligningen
6.1. P*V=n*R*T
6.1.1. p = tryk
6.1.1.1. [bar]
6.1.2. V = volumen
6.1.2.1. [liter]
6.1.3. n = stofmængde
6.1.3.1. [mol]
6.1.4. R = gaskonstant
6.1.4.1. 0,0831 [(bar*liter)/(mol*kelvin)]
6.1.5. T = temperatur
6.1.5.1. [kelvin]

