1. Compressão= 1/Porosidade
1.1. COMPRIMIDOS
1.2. SUPOSITÓRIOS
2. ASPECTO
2.1. Forma como se apresenta
2.2. Importante na Identidade/ identificação/ caracterização do produto
2.3. COR; OPACO, CRISTALINO; LEVE, DENSO, APARÊNCIA
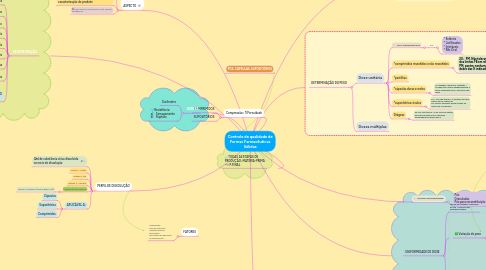
3. DESINTEGRAÇÃO
3.1. Comprimidos não revestidos
3.1.1. 6 unid= 30 min desintegrados (Téc.1)
3.2. * Drágeas ou Revestidos com Filme
3.2.1. 6 unidades Drágeas: 30’ Reves. Filme: 60 ‘
3.3. * Revestimento Entérico
3.3.1. 6 unidades para teste; HCl 0,1M e depois - tampão fosfato pH 6.8 =desint.
3.4. * Comprimidos Sublinguais
3.4.1. Técnica 1; desintegração após 5'
3.5. * Comprimidos Solúveis
3.5.1. TECNICA 1 mas com o líquido de imersão entre 15º e 25º = Desin. 3'
3.6. * Comprimidos Dispersíveis
3.7. * Cápsulas Duras
3.7.1. Desintegradas em 45' ou restando fragmentos insolúveis moles.
3.8. * Cápsulas Moles
3.8.1. Desintegradas em 30' ou restando fragmentos insolúveis moles.
3.9. NÃO APLICAVEL - AÇÃO PROLONGADA
3.9.1. Pastilhas
3.9.2. Cápsulas
3.9.3. Comprimidos
4. DUREZA
4.1. Durômetro
4.2. Resistência: a) Esmagamento b) Ruptura
5. PERFIL DE DISSOLUÇÃO
5.1. Qtd de substância ativa dissolvida no meio de dissolução
5.2. método 1- Cestas
5.3. método 2- Pás
5.4. método 3 - Cilindros
5.5. LIBERAÇÃO RETARDADA
5.5.1. Método A Método B (Ácido e Basico –FB)
5.6. APLICÁVEL A:
5.6.1. Cápsulas
5.6.2. Supositórios
5.6.3. Comprimidos
6. TODAS AS ETAPAS DE PRODUÇÃO: MATÉRIA-PRIMA --> P.FINAL
7. PÓS, CAPSULAS, SUPOSITÓRIOS
8. FATORES
8.1. Solubilidade; Área de superfície; Natureza química; Excipientes; Tecnologia de Fabricação; Armazenamento
9. • ENVASE: HOMOGENEIDADE
9.1. Pós Granulados Pós para reconstituição
10. FRIABILIDADE
10.1. Friablômetro
10.2. Resistencia à abrasão
10.3. Lascado, Partido, Rachado Quebrado
11. DETERMINAÇÃO DO PESO
11.1. Dose unitária
11.1.1. • LOTE: uniformidade PESO
11.1.1.1. pós
11.1.1.1.1. * Estéreis * Liofilizados * Injetáveis * Rec.Oral
11.1.2. *comprimidos revestidos e não revestidos
11.1.2.1. 20 ; PM. Não tolerar + 2 unidades fora dos limites FB em relação ao PM, porém, nenhuma acima/ abaixo do dobro das % indicadas
11.1.3. *pastilhas
11.1.4. *cápsulas duras e moles
11.1.4.1. 20 unidades, remover o conteúdo de cada uma, limpar adequadamente e pesar novamente.Peso=cap cheia-cap vazia.
11.1.5. *supositórios; óvulos
11.1.5.1. 20 ; PM. Não tolerar + 2 unidades fora dos limites FB em relação ao PM, porém, nenhuma acima/ abaixo do dobro das % indicadas
11.1.6. Drágeas
11.1.6.1. 20 ;PM; Não tolerar + 5 un. fora dos limites da FB em relação ao PM, nenhuma acima/abaixo do dobro das %
11.2. Doses múltiplas
12. UNIFORMIDADE DE DOSE
12.1. Qtd PA em unidades individuais do lote = uniforme nas unidades testadas.
12.2. Variação de peso
12.2.1. ≥25 mg e ≥ 25%
12.2.1.1. Comprimidos (rev filme/não-rev)
12.2.1.2. Capsulas duras
12.2.1.3. Pós liofilizados
12.2.2. < 25 mg ou < 25%
12.2.2.1. Pós liofilizados
12.3. Uniformidade de Conteúdo
12.3.1. ≥25 mg e ≥ 25%
12.3.1.1. Comprimidos rev(não filme)/ Outros sólidos
12.3.2. < 25 mg ou < 25%
12.3.2.1. Comprimidos
12.3.2.2. Capsulas duras e moles
12.3.2.3. Outros
13. TEOR
13.1. Quantificação - Obedecer técnica referente ao produto
13.1.1. TITULAÇÃO CLÁSSICA
13.1.2. TITULAÇÃO POTENCIOMÉTRICA
