Альдегиды
by Pavel Karpov
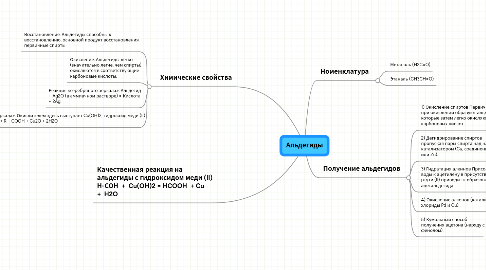
1. Химические свойства
1.1. Восстановление. Альдегиды способны к восстановлению, основной продукт восстановления — первичные спирты.
1.2. Окисление. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты.
1.3. Реакция «серебряного зеркала». Альдегид + Ag2O (в аммиачном растворе) = Кислота + 2Ag.
1.4. Реакция «медного зеркала». Окислителем здесь выступает Cu(OH)2, гидроксид меди (II) R—COH + 2Cu(OH)2 → R—COOH + Cu2O + 2H2O
2. Качественная реакция на альдегиды с гидроксидом меди (II) Н-СОН + Cu(OH)2 = HCOOH + Cu + H2O
3. Номенклатура
3.1. Метаналь (H2C=O)
3.2. Этаналь (CH3CH=O)
4. Получение альдегидов
4.1. 1) Окисление спиртов Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
4.2. 2) Дегидрирование спиртов пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
4.3. 3) Гидратация алкинов Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида
4.4. 4) Окисление алкенов (катализаторы - хлориды Pd и Cu)
4.5. 5) Кумольный способ получения ацетона (наряду с фенолом).


