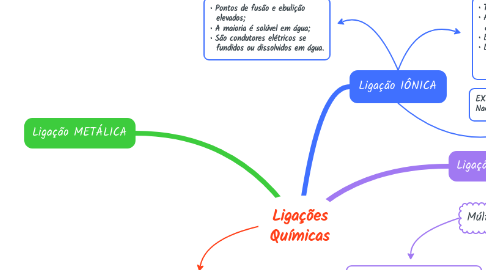
Ligações Químicas
作者:Jussara Morais
1. A combinação de átomos, moléculas e íons em que toda substância química busca estabilidade
2. REGRA DE OCTETO
3. Átomos tendem a ganhar, perder ou compartilhar elétrons até que estejam circundados por oito elétrons de valência
4. • Transferência de elétrons; • Atração eletrostática entre dois íons carregados com cargas opostas; • Eletronegativos + eletropositivos; • Ligação entre metais + não metais metais + semimetais metais + hidrogênio
5. • Pontos de fusão e ebulição elevados; • A maioria é solúvel em água; • São condutores elétricos se fundidos ou dissolvidos em água.
6. EXEMPLOS DE COMPOSTOS IÔNICOS: NaCl, CaS, K2O, LiF, CaCO3
7. Estabilidade com menos de 8 elétrons. Ex: berílio (Be) e com o boro (B)
8. Ligação METÁLICA
9. Ligação COVALENTE
10. Ligação IÔNICA
11. • Substância molecular; • Compartilhamento de pares de elétrons; • Necessitam ganhar elétron para manter sua estabilidade; • Eletronegativo + eletronegativo; • Ligações entre não metais + não metais não metais + hidrogênio hidrogênio + hidrogênio
12. SIMPLES: um par de elétrons; (-) σ
13. DUPLA: dois pares de elétrons; (=), σ, π
14. TRIPLA: três pares de elétrons; (≡), σ, π, π
15. • Pontos de fusão e ebulição baixos; • São isolantes elétricos com exceção do grafite: • São encontrados nos estados sólidos líquido e gasoso; • As ligações moleculares são formadas por ligação do tipo sigma (σ) e/ou pi (π)
16. Múltiplas ligações
17. Estabilidade com mais de 8 elétrons. Ex: enxofre (S) e o fósforo (P)
18. Moléculas com número ímpar de elétrons. Ex: dióxido de nitrogênio (NO2)
19. EXCEÇÕES
20. Em 1916 Por Walther Kossel e Newton Lewis
21. EXEMPLOS DE COMPOSTOS COVALENTES: HCl, H2O, O2, CH4,


