1. COS'E'?
1.1. la distillazione è un processo che consente di separare due o più liquidi caratterizzati da PUNTI DI EBOLLIZIONE DIVERSI
2. SEPARO DUE FRAZIONI
2.1. FRAZIONE EVAPORATA
2.1.1. risulta arricchita di componenti più volatili cioè quelli che presentano PUNTI DI EBOLLIZIONE PIU' BASSI
2.2. FRAZIONE CHE RIMANE LIQUIDA
2.2.1. è la frazione più ricca di componenti meno volatili, cioè di quelli con PUNTO DI EBOLLIZIONE PIU' ALTO
3. COSA DEVO SAPERE QUANDO AFFRONTO IL TEMA?
3.1. La tensione di vapore di un liquido puro è la pressione del vapore saturo presente sopra lo stesso liquido contenuto in un recipiente chiuso. UN VAPORE SI DICE SATURO quando è in presenza del liquido che lo ha generato e si trova nella condizione in cui il numero delle molecole che evaporano dal liquido è uguale al numero delle molecole che condensano.
3.1.1. E' PROPORZIONALE ALLA TEMPERATURA
3.2. TENSIONE DI VAPORE
3.3. LEGGE DI RAOULT
3.3.1. Riguarda la tensone di vapore di una miscela di liquidi PERFETTAMENTE MISCIBILI TRA DI LORO
3.3.2. ENUNCIATO
3.3.2.1. AFFERMA CHE LA TENSIONE DI VAPORE DI UN LIQUIDO DI UNA MISCELA AD UNA DATA TEMPERATURA E' UGUALE ALLA TENSIONE DI VAPORE DEL LIQUIDO PURO (ALLA STESSA TEMPERATURA) MOLTIPLICATA PER LA SUA FRAZIONE MOLARE NELLA SOLUZIONE IN ESAME
3.3.3. FORMULA
3.3.3.1. Pa=Pa puro* xa Pb=Pb puro* xb Pmiscela = Pa + Pb = Pa*xa + Pb*xb
3.3.4. GRAFICO
3.3.4.1. RAOULT
3.4. TEMPERATURA DI EBOLLIZIONE
3.4.1. E' rappresentata dalla temperatura alla quale la tensione di vapore del liquido è pari alla pressione esercitata sulla superficie del liquido stesso. E' ovvio dedurre che MINORE E' LA PRESSIONE SOPRA UN LIQUIDO MINORE SARA' LA SUA TEMPERATURA DI EBOLLIZIONE.
3.5. DIAGRAMMA DI EQUILIBRIO
3.5.1. *curva di bolla = curva di ebollizione. IL DIAGRAMMA E' A PRESSIONE COSTANTE, QUINDI NE AVRO' UNO DIVERSO PER OGNI PRESSIONE DIVERSA
3.6. MISCELE AZEOTROPICHE
3.6.1. Alcune coppie di sostanze presentano andamenti diversi non riconducibili al "diagramma di equilibrio".In questi diagrammi troviamo a differenza di quelli di equilibrio dei MASSIMI o dei MINIMI corrispondenti rispettivamente ai punti di ebollizione e a quelli di rugiada. in questi punti le due curve sono tangenti ( OVVERO SI TOCCANO IN UN PUNTO) la composizione del liquido coincide con quella del vapore. Queste miscele vengono dette AZEOTROPICHE.
3.6.1.1. AZEOTROPO DI MASSIMA
3.6.1.2. AZEOTROPO DI MINIMA
3.6.2. per cosa ci interessano queste miscele in relazione alla tecnica di distillazione???? NON POSSONO ESSERE DISTILLATE!
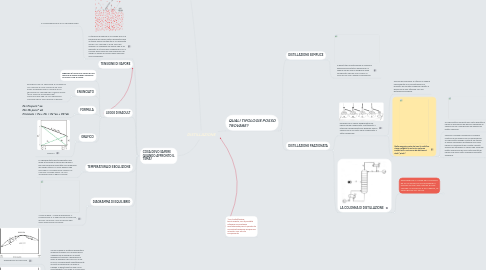
4. QUALI TIPOLOGIE POSSO TROVARE?
4.1. DISTILLAZIONE SEMPLICE
4.1.1. in questi tipo di distillazione la soluzione liquida viene portata a ebollizione e il vapore che da essa si sprigiona viene condensato SENZA CHE TORNI IN CONTATTO con il liquido in ebollizione
4.2. DISTILLAZIONE FRAZIONATA
4.2.1. prevede che il vapore sprigionatosi dal liquido venga condensato e sottoposto a ulteriore riscaldamento per generare nuovo vapore che a sua volta viene condensato e fatto rievaporare.
4.2.1.1. Alla fine del processo si ottiene un vapore che presenta una concentrazione di prodotto più volatile maggiore rispetto a quella che si può ottenere con una distillazione semplice.
4.2.1.2. Nella maggior parte dei casi la rettifica viene eseguita in un'unica colonna suddivisa in varie zone da diaframmi detti "piatti".
4.2.1.2.1. su ogni piatto è presente una certa quantità di liquido in ebollizione dal quale si sprigiona un vapore che va a condensarsi nel liquido del piatto superiore.
4.2.1.2.2. Poichè le colonne funzionano in maniera continua è necessario che la composizone su ogni piatto rimanga costante nel tempo. E' quindi necessario reintegrare nella fase liquida il componente più volatile. Questo avviene sia attraverso il vapore che viene dal piatto inferiore sia da una certa quantità di liquido che viene fatto scendere dal piatto superiore.
4.2.2. LA COLONNA DI DISTILLAZIONE
4.2.2.1. RAPPRESENTA IL CUORE DELL'IMPIANTO ED HA LO SCOPO DI MASSIMIZZARE IL CONTATTO FRA FASE LIQUIDA E FASE VAPORE. LA SOMMITA' E' PIU' FREDDA, LA PARTE BASSA PIU' CALDA.
4.2.2.1.1. COLONNA A PIATTI
4.2.2.1.2. COLONNE A RIEMPIMENTO

