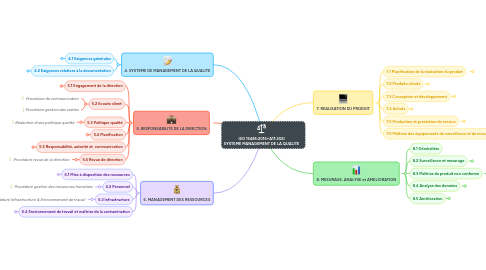
1. 4. SYSTEME DE MANAGEMENT DE LA QUALITE
1.1. 4.1 Exigences générales
1.1.1. 💡Cartographie des processus de l'entreprise
1.1.2. 💡 Fiche processus avec KPI, Risques associés, Pilotes, Description données d'entrée/ sortie et activités.
1.1.3. 💡Procédure de validation des applications logicielles
1.1.4. 💡 Procédure gestion des risques
1.2. 4.2 Exigences relatives à la documentation
1.2.1. 4.2.1 - Généralités
1.2.2. 4.2.2 - Manuel qualité
1.2.2.1. 💡Rédaction d'un manuel qualité
1.2.3. 4.2.3 - Dossier du dispositif médical
1.2.3.1. 💡Relié au dossier technique des dm logiciels développés
1.2.4. 4.2.4 - Maîtrise des documents / enregistrements
1.2.4.1. 💡Procédure Gestion des documents & enregistrements
2. 5. RESPONSABILITE DE LA DIRECTION
2.1. 5.1 Engagement de la direction
2.1.1. 💡Voir la politique qualité
2.2. 5.2 Ecoute client
2.2.1. 💡 Procédure de communication
2.2.2. 💡Procédure gestion des ventes
2.3. 5.3 Politique qualité
2.3.1. 💡Rédaction d'une politique qualité
2.4. 5.4 Planification
2.4.1. 5.4.1 - Objectifs qualités
2.4.1.1. 💡Mentionnés dans la politique qualité
2.4.2. 5.4.2 - Planification du système de management de la qualité
2.4.2.1. 💡QMS Plan
2.5. 5.5 Responsabilité, autorité et communication
2.5.1. 5.5.1 - Responsabilité et autorité
2.5.1.1. 💡 Organigramme entreprise + Procédure Ressources humaines
2.5.2. 5.5.2 - Représentant de la direction
2.5.2.1. 💡Processus affaires légales et règlementaires
2.5.3. 5.5.3 - Communication interne
2.5.3.1. 💡Procédure de communication
2.6. 5.6 Revue de direction
2.6.1. 💡 Procédure revue de la direction
3. 6. MANAGEMENT DES RESSOURCES
3.1. 6.1 Mise à disposition des ressources
3.1.1. 💡 Processus gestion des ressources
3.2. 6.2 Personnel
3.2.1. 💡 Procédure gestion des ressources humaines
3.3. 6.3 Infrastructure
3.3.1. 💡 Procédure Infrastructure & Environnement de travail
3.4. 6.4 Environnement de travail et maîtrise de la contamination
3.4.1. ❌ Non applicable
4. 7. REALISATION DU PRODUIT
4.1. 7.1 Planification de la réalisation du produit
4.1.1. 💡 Procédure réalisation des produits
4.1.2. 💡 Procédure gestion des risques
4.1.3. 💡 Procédure Analyse des données
4.2. 7.2 Produits clients
4.2.1. 7.2.1 - Détermination des exigences relatives au produit
4.2.1.1. 💡 Procédure réalisation des produits
4.2.1.2. 💡 Liste des textes réglementaires applicables
4.2.2. 7.2.2 - Revue des exigences relatives au produit
4.2.2.1. 💡 Procédure réalisation des produits
4.2.3. 7.2.3 - Communication
4.2.3.1. 💡 Procédure de communication
4.2.3.2. 💡Procédure gestion des retours informations et plaintes
4.2.3.3. 💡Procédure gestion des ventes
4.3. 7.3 Conception et développement
4.3.1. 7.3.1 Généralités
4.3.1.1. 💡 Procédure réalisation des produits
4.3.2. 7.3.2 Planification de la conception et du développement
4.3.2.1. 💡 Procédure réalisation des produits
4.3.3. 7.3.3 Eléments d’entrée de la conception et du développement
4.3.3.1. 💡 Procédure réalisation des produits
4.3.4. 7.3.4 Eléments de sortie de la conception et du développement
4.3.4.1. 💡 Procédure réalisation des produits
4.3.5. 7.3.5 Revue de la conception et du développement
4.3.5.1. 💡 Procédure réalisation des produits
4.3.6. 7.3.6 Vérification de la conception et du développement
4.3.6.1. 💡 Procédure réalisation des produits
4.3.7. 7.3.7 Validation de la conception et du développement
4.3.7.1. 💡 Procédure réalisation des produits
4.3.7.2. 💡 Procédure ingénierie d'aptitude à l'utilisation
4.3.7.3. 💡 Procédure gestion clinique
4.3.8. 7.3.8 Transfert de la conception et du développement
4.3.8.1. 💡 Procédure réalisation des produits
4.3.9. 7.3.9 Maîtrise des modifications de la conception et du développement
4.3.9.1. 💡 Procédure gestion des modifications
4.3.10. 7.3.10 Dossiers de la conception et du développement
4.3.10.1. 💡 Procédure réalisation des produits
4.4. 7.4 Achats
4.4.1. 7.4.1 - Processus d'achat
4.4.1.1. 💡Procédure achat
4.4.2. 7.4.2 - Informations relatives aux achats
4.4.2.1. 💡Procédure achat
4.4.3. 7.4.5 - Vérification du produit acheté
4.4.3.1. 💡Procédure achat
4.5. 7.5 Production et prestation de service
4.5.1. 7.5.1 - Maîtrise de la production et de la prestation de service
4.5.1.1. 💡 Procédure réalisation des produits
4.5.1.2. 💡 Procédure Analyse des données
4.5.2. 7.5.2 - Propreté du produit
4.5.2.1. ❌ Non applicable
4.5.3. 7.5.3 - Activités d'installation
4.5.3.1. 💡 Instruction d'installation
4.5.4. 7.5.4 - Prestations associées
4.5.4.1. 💡Procédure de résolution de problème logiciel
4.5.5. 7.5.5 - Exigences particulières pour les dispositifs médicaux stériles
4.5.5.1. ❌ Non applicable
4.5.6. 7.5.6 - Validation des processus de production et de prestation de service
4.5.6.1. 💡Procédure de validation des applications logicielles
4.5.6.2. 💡 Procédure réalisation des produits
4.5.7. 7.5.7 - Exigences spécifiques relatives à la validation des procédés de stérilisation et des systèmes de barrière stérile
4.5.8. 7.5.8 - Identification
4.5.8.1. 💡 Procédure réalisation des produits
4.5.9. 7.5.9 - Traçabilité
4.5.9.1. 7.5.9.1 - Généralités
4.5.9.1.1. 💡 Procédure réalisation des produits
4.5.9.1.2. 💡Procédure Gestion des documents & enregistrements
4.5.9.2. 7.5.9.2 - Exigences particulières pour des dispositifs médicaux implantables
4.5.9.2.1. ❌ Non applicable
4.5.10. 7.5.10 - Propriété du client
4.5.10.1. 💡Procédure gestion des ventes
4.5.11. 7.5.11 - Préservation du produit
4.5.11.1. 💡 Procédure réalisation des produits
4.5.11.2. 💡 Procédure Infrastructure & Environnement de travail
4.6. 7.6 Maîtrise des équipements de surveillance et de mesure
4.6.1. 💡Procédure de validation des applications logicielles
5. 8. MESURAGE, ANALYSE et AMELIORATION
5.1. 8.1 Généralités
5.2. 8.2 Surveillance et mesurage
5.2.1. 8.2.1 - Retours d'information
5.2.1.1. 💡Procédure gestion des retours informations et plaintes
5.2.2. 8.2.2 - Traitement des réclamations
5.2.2.1. 💡Procédure gestion des retours informations et plaintes
5.2.3. 8.2.3 - Signalement aux autorités réglementaires
5.2.3.1. 💡 Procédure de communication
5.2.4. 8.2.4 - Audit interne
5.2.4.1. 💡 Procédure audit
5.2.5. 8.2.5 - Surveillance et mesure des processus
5.2.5.1. 💡 Procédure Analyse des données
5.2.5.2. 💡 Procédure audit
5.2.5.3. 💡 Procédure revue de la direction
5.2.6. 8.2.6 - Surveillance et mesure du produit
5.2.6.1. 💡 Procédure Analyse des données
5.2.6.2. 💡 Procédure audit
5.2.6.3. 💡 Procédure revue de la direction
5.2.6.4. 💡 Procédure PMS
5.3. 8.3 Maîtrise du produit non conforme
5.3.1. 8.3.1 - Maîtrise du produit non conforme
5.3.1.1. 💡 Procédure gestion d'événements de qualité
5.3.2. 8.3.2 - Actions en réponse à une non-conformité du produit détectée avant livraison
5.3.2.1. 💡 Procédure gestion d'événements de qualité
5.3.3. 8.3.3 - Actions en réponse à une non-conformité du produit détectée après livraison
5.3.3.1. 💡 Procédure gestion d'événements de qualité
5.3.4. 8.3.4 - Retouches
5.3.4.1. 💡 Procédure réalisation des produits
5.3.4.2. 💡 Procédure gestion des modifications
5.4. 8.4 Analyse des données
5.4.1. 💡 Procédure Analyse des données
5.5. 8.5 Amélioration
5.5.1. 8.5.1 - Généralités
5.5.1.1. 💡 Procédure veille réglementaire & technologique
5.5.1.2. 💡 Procédure Surveillance après commercialisation
5.5.1.3. 💡 Procédure gestion des risques
5.5.2. 8.5.2 - Actions correctives
5.5.2.1. 💡 Procédure gestion d'événements de qualité
5.5.3. 8.5.3 - Actions préventives
5.5.3.1. 💡 Procédure gestion d'événements de qualité
