FUNÇÕES ORGÂNICAS
por Joao Canuto

1. HIDROCARBONETOS
1.1. São compostos orgânicos formados por carbono e hidrogênio e compõem a base da química orgânica.
1.2. Em geral, os hidrocarbonetos são compostos apolares e, por isso, insolúveis em água.
1.3. As interações intermoleculares entre hidrocarbonetos são do tipo dipolo induzido, a mais fraca das interações.
1.3.1. Entretanto, quanto maior a cadeia carbônica mais interações são realizadas.
1.4. Metano
1.5. CADEIAS ACÍCLICAS
1.5.1. ALCANOS
1.5.1.1. Ligação simples
1.5.2. ALCENOS
1.5.2.1. Ligação dupla
1.5.3. ALCINOS
1.5.3.1. Ligação tripla
1.5.4. ALCADIENOS
1.5.4.1. Duas ligações duplas
1.5.5. ALCADIINOS
1.5.5.1. Duas ligações triplas
1.6. CADEIAS CÍCLICAS
1.6.1. CICLANOS
1.6.1.1. Cadeia fechada e saturada
1.6.2. AROMÁTICOS
1.6.2.1. Cadeia fechada com ligações duplas alternadas, que formam o chamado anel benzênico
1.6.2.1.1. sofrem o fenômeno de ressonância
1.6.3. CICLENOS
1.6.3.1. Cadeia fechada e insaturada
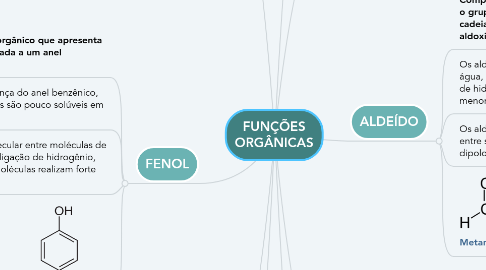
2. FENOL
2.1. Composto orgânico que apresenta hidroxila ligada a um anel benzênico.
2.2. Devido a presença do anel benzênico, apolar, os fenóis são pouco solúveis em água.
2.3. A interação molecular entre moléculas de fenóis é do tipo ligação de hidrogênio, portanto, suas moléculas realizam forte interação.
2.4. Hidroxibenzeno
3. CETONA
3.1. Composto orgânico que apresenta o grupo carbonila no meio da cadeia.
3.2. É solúvel em água quando estabelece ligações de hidrogênio.
3.3. As moléculas de cetonas interagem entre si por meio de ligações do tipo dipolo permanente.
3.4. Propanona
4. ÉSTER
4.1. Composto orgânico derivado do ácido carboxílico, em que o H da carboxila é substituído por um grupo alifático ou aromático.
4.2. Devido a baixa polaridade os ésteres são pouco solúveis em água.
4.3. Os ésteres são pouco polares, por isso, realizam interação molecular do tipo dipolo permanente.
4.4. Etanoato de etila
5. ÁLCOOL
5.1. Composto orgânico que apresenta hidroxila ligada a um carbono saturado.
5.2. Devido a presença da hidroxila todo álcool possui uma parte polar, por isso, é solúvel em água.
5.2.1. Entretanto, a partir de 4 carbonos a solubilidade diminui conforme o aumento da cadeia carbônica.
