TERMOQUÍMICA
por Andrya Gabrielly
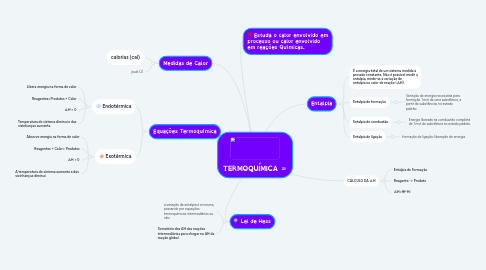

1. Estuda o calor envolvido em processo ou calor envolvido em reações Químicas.
2. Equações Termoquímica
2.1. Endotérmica
2.1.1. Libera energia na forma de calor
2.1.2. Reagentes=Produtos + Calor
2.1.3. ∆H < 0
2.1.4. Temperatura do sistema diminui e das vizinhanças aumenta
2.2. Exotérmica
2.2.1. Absorve energia na forma de calor
2.2.2. Reagentes + Calor= Produtos
2.2.3. ∆H > 0
2.2.4. A temperatura do sistema aumenta e das vizinhanças diminui
3. Lei de Hess
3.1. a variação de entalpia é a mesma, passando por equações termoquímicas intermediárias ou não.
3.2. Somatório dos ΔH das reações intermediárias para chegar no ΔH da reação global.
4. Medidas de Calor
4.1. calorias (cal)
4.2. joule (J)
5. CÁLCULO DA ∆H
5.1. Entalpia de Formação
5.2. Reagente -> Produto
5.3. ∆H=Hf-Hi
6. Entalpia
6.1. É a energia total de um sistema medida à pressão constante. Não é possível medir a entalpia, mede-se a variação de entalpia ou calor de reação (∆H).
6.2. Entalpia de formação
6.2.1. Variação de energia necessária para formação 1 mol de uma substância, a partir de substâncias no estado padrão.
6.3. Entalpia de combustão
6.3.1. Energia liberada na combustão completa de 1 mol de substância no estado padrão.
6.4. Entalpia de ligação
6.4.1. formação de ligação: liberação de energia.
