1. Son
1.1. Macromoléculas orgánicas de elevado peso molecular. Compuestos químicos complejos que están en todas las células vivas
1.1.1. Tienen cabrono, hidrogeno, oxigeno y nitrógeno.
1.1.1.1. Según su tamaño moléculas, pueden ser Oligopéptidos (menos de 10Aa). Polipéptidos (mas de 10Aa). Mas de 50Aa y el polipéptido tiene una estructura tridimensional específica, entonces son proteínas
1.2. Se clasifican en:
1.3. Holoproteínas
1.3.1. filamentosas
1.3.2. globulares
1.3.3. cromo proteínas
1.3.4. glucoproteínas
1.4. Heteroproteínas
1.4.1. nucleoproteínas
1.4.2. lipoproteínas
1.4.3. fosfoproteínas
1.5. Están compuestos orgánicos de bajo peso molecular Tienen un grupo carboxilo (-COOH) y un grupo amino (-NH2) unidas al mismo carbono (carbono 𝛂)
1.6. Aminoácidos esenciales:
1.6.1. Los que los organismos heterótrofos tienen que tomar de su dieta ya que no pueden sintetizarlos en su cuerpo (los autótrofos pueden sintetizarlos todos). Las rutas metabólicas para obtenerlas ser largas y energéticamente costosas. (es menos costoso obtenerlas en los alimentos)
1.6.1.1. Adultos
1.6.1.1.1. ○ Fenilalanina ○ Isoleucina ○ Leucina ○ Lisina ○ Metionina ○ Treonina ○ Triptófano ○ Valina
1.6.1.2. Niños
1.6.1.2.1. ○ Todos los anteriores ○ Arginina ○ Histidina
1.7. Los aminoácidos se unen entre sí mediante uniones peptídicas para formar cadenas lineales no ramificadas. Existe un amino N-terminal (amino inicio) y C-terminal (carboxilo final). Hay los que transportan hidrógeno, hormonales y antibiótico
1.8. Se forman por AMINOÁCIDOS
1.9. Según la polaridad del radical:
1.9.1. HIDRÓFOBOS- R no polar
1.9.1.1. EJ: leucina
1.9.2. HIDRÓFILOS- R polar sin carga
1.9.2.1. EJ: glutamina
1.9.3. ÁCIDOS- Tienen carboxilos en R, que normalmente está ionizado
1.9.3.1. EJ: ácido espártico
1.9.4. BÁSICOS- Tienen R que se carga positivamente a pH neutro
1.9.4.1. EJ: metionina
1.10. Según la estructura del radical:
1.10.1. ALFIPÁTICOS- aminoácidos en los que el radical R es una cadena hidrocarbonada abierta que puede tener además grupos -COOH y -NH2. los aminoácidos alifáticos se clasifican en neutros, ácidos y básicos § Ácidos- radical tiene grupos carboxilos pero no amino § Básicos- radical tiene grupos amino pero no carboxilo § Neutros- radical no tiene grupos carboxilo ni amino
1.10.1.1. EJ: leucina
1.10.2. AROMÁTICOS- radical es una cadena errada relacionada generalmente con el benceno.
1.10.2.1. EJ: triptófano
1.10.3. HETEROCÍCLICOS- radical es cadena cerrada, compleja y con algunos átomos distintos del carbono y del hidrógeno.
1.10.3.1. EJ: prolina
1.11. Propiedades de los aminoácidos:
1.11.1. 1. Compuestos solidos
1.11.2. 2. Compuestos cristalinos
1.11.3. 3. Elevado punto de fusión
1.11.4. 4. Solubles en agua
1.11.5. 5. Actividad óptica (reflejan la luz)
1.11.6. 6. Comportamiento químico anfótero ya que en pH=7 tienen ionización dipolar llamada zwitterion, que se queda en equilibrio con la forma no iónica.
2. Estructura
2.1. Primaria
2.1.1. Es la más básica nos dice que aminoácidos componen la cadena principal y el orden en el que se encuentran. Cuando se cambia una base nitrogenada para la formación de una proteína llegan a haber trastornos críticos como la anemia falciforme (hace que los glóbulos rojos se deformen y pueden causar hinchazón en manos y pies, fatiga o irritabilidad, color amarillento en la piel o blanco de los ojos.). Un EJEMPLO es la insulina
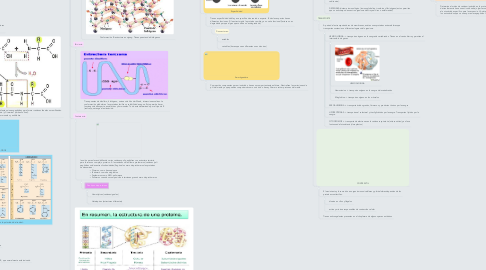
2.2. Secundaria
2.2.1. hay uniones por los puentes de hidrógeno. Hay dos tipos de estructuras= alfa hélice y lámina plegada Beta. El colágeno tiene una conformación de hélice mas alargada que la a-hélice, por la abundancia de prolina e hidroxiprolina.
2.2.1.1. Conformación A: Es una triple hélice. Un EJEMPLO es el síndrome de Marfán que genera un soplo en el corazón, dolores graves de espalda, dedos largos, huesos frágiles, miopía extrema.
2.2.1.2. Conformación B: estructura en zigzag. Tienen puentes de hidrógenos
2.3. Terciaria
2.3.1. Tiene puentes de disulfuro, hidrógeno, uniones de Van der Waals, interacciones salinas. La conformación globular en las proteínas facilita su solubilidad en agua. Esto permite hacer funciones de transporte, enzimáticas y hormonales. Todo esta determinado por el tipo de R (radical) que tenga el aminoácido.
2.4. Cuaternaria
2.4.1. la unión por enlaces débiles de varias cadenas poli peptídicas con estructura terciaria, para formas un complejo proteico. A las cadenas se les llama protómeros (cadenas poli peptídicas unidas entre si/subunidades) Según el numero de protómeros las proteínas se denominan: ○ Dímeros, como hexoquinasa ○ Tetrámero como hemoglobina ○ Pentámeros como ARN-polimerasa ○ Polímeros cuando su composición intervienen gran número de protómeros
2.4.1.1. Dos tipos de proteínas
2.4.1.1.1. Homotípicas (cadenas iguales)
2.4.1.1.2. Heterópicas (estructuras diferentes)
2.5. RESUMEN
3. Función
3.1. ESTRUCTURAL
3.1.1. Las glucoproteínas son parte de membranas celulares, e intervienen en la bomba de Ns-K (transporte selectivo de iones)
3.1.2. Puede formar parte de cilios, flagelos, citoesqueleto de células y fibras del huso
3.1.3. Las HISTONAS son parte de cromosomas eucariotas
3.1.4. COLÁGENO mantiene unidos a los tejidos animales y forma tendones, matriz de huesos y cartílagos
3.1.5. la QUERATINA sintetiza la epidermis y es parte de pelos, uñas, escamas de reptiles, plumas
3.1.6. la FIBROINA forma la seda y tela de arañas
3.2. ENZIMÁTICA
3.2.1. la mas importante ya que van a controlar la velocidad de una reacción. Son específicas para un sustrato (sustancia que se va a modificar). Tienen especificidad y controlan velocidad. Disminuyen a energía de activación (energía de arranque) para aumentar la velocidad de las reacciones.
3.2.1.1. HORMONALES (insulina y glucagón, hormona de crecimiento, calcitonina).
3.2.1.2. DEFENSIVA (sistema inmunológico (inmunoglobulina, trombina y fibrinógeno) estos permiten que un anticuerpo de nuestro organismo destruya el virus o enfermedad)
3.3. TRANSPORTE
3.3.1. A parte de las transportadoras de membranas, existen unas proteínas extracelulares que transportan sustancias a diferentes lugares del organismo
3.3.1.1. HEMOGLOBINA -> transporta oxígeno en la sangre de vertebrados. Tienen en el centro hierro y permiten el intercambio de gases
3.3.1.1.1. HEMOGLOBINA
3.3.1.1.2. Hemocianina -> transporta oxígeno en la sangre de invertebrados
3.3.1.1.3. Mioglobina -> transporta oxígeno en los músculos
3.3.1.2. SEROALBÚMINA -> transporta ácidos grados, fármacos y productos tóxicos por la sangre
3.3.1.3. LIPOPROTEÍNAS -> transportan el colesterol y triacilglicéridos por la sangre. Transportan lípidos por la sangre.
3.3.1.4. CITOCROMOS -> transporte de electrones en la cadena respiratoria (mitocondrias) y en fase luminosa de fotosíntesis (cloroplastos)
3.4. CONTRÁCTIL
3.4.1. El movimiento y locomoción en organismos unicelulares y pluricelulares dependen de las proteínas contráctiles.
3.4.1.1. dineina en cilios y flagelos
3.4.1.2. actina y miosina responsables de contracción celular
3.4.2. Tienen anticongelantes presentes en el citoplasma de algunos peces antárticos
4. Síntesis
4.1. Dos etapas:
4.2. TRANSCRIPCIÓN
4.2.1. Sucede dentro del núcleo células eucariotas. Se forma ARN mensajero
4.2.1.1. La molécula helicoidal ADN se desenrolla, se abre, y lo controla una polimerasa del ARN (promotor) y se marca el inicio de la síntesis. Se añaden uno por uno los nucleótidos con los complementarios (A-U, T-A, C-G, G-C). Es una cadena complementaria del ARN. Los tripletes son tres nucleótidos que van a determinan el aminoácido que debe colocarse, a esto se le llama "codón".
4.3. TRADUCCIÓN
4.3.1. Determina el orden de cada aminoácido en la proteína. Se lleva a cabo en el ribosoma. El ARN de transferencia tiene un anti codón abajo (parte complementaria de codón), este se une y tiene el aminoácido específico para la secuencia. LA síntesis de proteína se da a partir de la unión de los aminoácidos que se unen por enlace peptídico formando una proteína.
5. Propiedades
5.1. Solubilidad
5.1.1. Depende del pH, temperatura, concentración iónica. La solubilidad depende de los radicales R que al ionizarse hacen puentes de hidrógeno con las moléculas de agua. Las proteínas son solubles en agua pero no entran fácilmente a la membrana, por lo que necesitan entradas por transporte activo.
5.2. Desnaturalización
5.2.1. Es la pérdida de estructura y función biológica.
5.2.1.1. FÍSICOS: calor y radiaciones
5.2.1.2. QUÍMICOS: detergentes, reactivos de grupos -SH, altas concentraciones de sal y extremos de pH
5.3. Especificidad
5.3.1. Tienen especificidad doble y es especifica de acuerdo a especie. Todas las especies tienen diferentes funciones. Si la estructura de la proteína cambia, ya no sería funcional (lactosa no es degradada porque el gen que codifica no es degradado).
5.3.1.1. Dos sectores:
5.3.1.1.1. estables
5.3.1.1.2. variables (hacen que sean diferentes unas de otras)
5.4. Amortiguadora
5.4.1. Como están compuestas por aminoácidos, tienen un comportamiento anfótero. Neutralizan las variaciones de pH del medio ya que pueden comportarse como un ácido o base y liberar o retirar protones del medio
