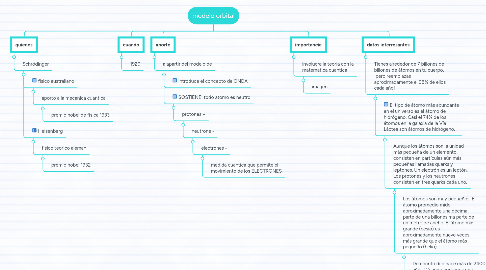
1. quienes
1.1. Schrödinger
1.1.1. fisico australiano
1.1.1.1. aporto a la mecanica cuantica
1.1.1.1.1. premio nobel de fisica 1933
1.1.2. Heisenberg
1.1.2.1. fisico teorico aleman
1.1.2.1.1. premio nobel 1932
2. cuando
2.1. 1920
3. aporte
3.1. a apartir del modelo de
3.1.1. introduce el concepto de ONDA
3.1.2. SOSTIENE: todo atomo es neutro
3.1.2.1. protones +
3.1.2.1.1. neutrone -
4. importancia
4.1. involucra la teoria con la matematica cuantica
4.1.1. imagen
5. datos interresantes
5.1. Tienes alrededor de 7 billones de billones de átomos en tu cuerpo, ¡pero reemplazas aproximadamente el 98% de ellos cada año!
5.1.1. El tipo de átomo más abundante en el universo es el átomo de hidrógeno. Casi el 74% de los átomos en la galaxia de la Vía Láctea son átomos de hidrógeno.
5.1.1.1. Aunque los átomos son la unidad más pequeña de un elemento, consisten en partículas aún más pequeñas llamadas quarks y leptones. Un electrón es un leptón. Los protones y los neutrones consisten en tres quarks cada uno.
5.1.1.1.1. Los átomos son muy pequeños. El átomo promedio mide aproximadamente una décima parte de una billonésima parte de un metro de ancho. El átomo más grande (cesio) es aproximadamente nueve veces más grande que el átomo más pequeño (helio).
