LEY DE GAY-LUSSAC
por Melissa Gutierrez
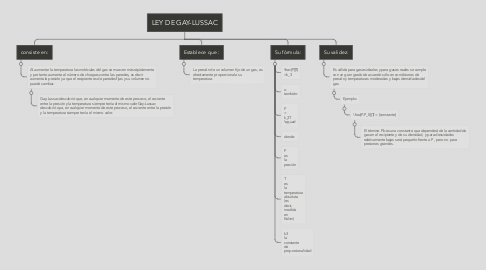

1. consiste en:
1.1. Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
1.1.1. Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valorGay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor.
2. Establece que :
2.1. La presión de un volumen fijo de un gas, es directamente proporcional a su temperatura.
3. Su fórmula:
3.1. \frac{P}{T} =k_3
3.2. o también:
3.3. P = k_3T \qquad
3.4. donde:
3.5. P es la presión
3.6. T es la temperatura absoluta (es decir, medida en Kelvin)
3.7. k3 la constante de proporcionalidad
4. Su validez:
4.1. Es válida para gases ideales y para gases reales se cumple con un gran grado de acuerdo sólo en condiciones de presión y temperaturas moderadas y bajas densidades del gas.
4.1.1. Ejemplo:
4.1.1.1. \frac{P-P_0}{T} = {constante}
4.1.1.1.1. El término Pb es una constante que dependerá de la cantidad de gas en el recipiente y de su densidad, y para densidades relativamente bajas será pequeño frente a P , pero no para presiones grandes.

