1. ¿QUÉ ES?
1.1. se da entre elementos que tienen valores de potencial de ionización y afinidad electrónica parecidas, puesto que en este caso ninguno de ellos puede arrancarle electrones al otro.
2. PROPIEDADES
2.1. Están formadas por moléculas independientes unidas entre sí por fuerzas débiles llamadas fuerzas intermoleculares.
2.2. Hallamos sustancias covalentes moleculares que a temperatura ambiente se hallan en estado gaseoso, otras en estado líquido y otras en estado sólido, dependiendo de la fortaleza de dichas fuerzas intermoleculares. No obstante, en general, presentan puntos de fusión y ebullición bajos, menores de 300º en todo caso
2.3. Solubilidad dependiente de su polaridad. Los polares son solubles en disolventes polares como agua o etanol, los apolares en disolventes apolares como benceno o hexano.
2.4. No conducen la corriente eléctrica o son muy malos conductores de la misma, porque los electrones se hallan muy localizados, y son moléculas independientes. Únicamente la conducen los compuestos covalentes muy polares en disolución acuosa que se puedan disociar como electrolitos, como el HCl, cloruro de hidrógeno, que disuelto en agua se disocia como H+ y Cl- y recibe el nombre de ácido clorhídrico (porque libera protones, H+).
2.5. Son blandos en estado sólido.
3. PARÁMETROS MOLECULARES
3.1. He aquí un pequeño vídeo.
4. EL AGUA
4.1. Un átomo de oxígeno tiene seis electrones en la última capa, por lo que le faltan dos para completarla. Es por ello que se une con dos átomos de hidrógeno, cada uno de los cuales aporta su único electrón. El resultado es que se forma una molécula de agua en la que existen dos enlaces covalentes oxígeno-hidrógeno.
5. EL AMONÍACO
5.1. El átomo de nitrógeno tiene cinco electrones en su última capa. Para completarla necesita tres electrones más. Por esta razón se une atre átomos de hidrógeno, cada uno de los cuales aporta su único electrón. El resultado es que se forma una molécula de amoníaco en la que hay tres enlaces covalentes nitrógeno-hidrógeno. La molécula de amoníaco es NH3.
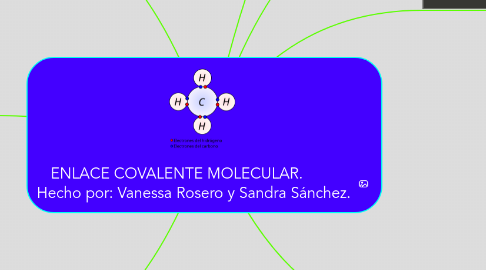
6. EL METANO
6.1. El carbono tiene cuatro electrones en su última capa, por lo que para llegar a completar esta capa con ocho electrones necesita otros cuatro. Por tanto, formará cuatro enlaces covalentes con otros tantos hidrógenos, cada uno de los cuales aporta su único electrón. Por tanto, en la molécula de metano hay cuatro enlaces covalentes carbono-hidrógeno. Su fórmula es CH4.
7. TEORÍAS DEL ENLACE COVALENTE
7.1. TEORÍA DEL ENLACE DE VALENCIA
7.1.1. Fue la primera teoría, basada en la mecánica cuántica, que se desarrolló para explicar el enlace en las moléculas covalentes. Se puede considerar que expresa el concepto de Lewis del enlace en términos de las funciones de ondas. En 1927, Heitler y London propusieron un tratamiento mecano-cuántico para la molécula de hidrógeno. Una estructura de enlace de valencia es similar a una estructura de Lewis, sin embargo, pueden escribirse varias estructuras de enlace de valencia donde no puede escribirse sólo una estructura de Lewis. Cada una de estas estructuras de EV representa a una estructura de Lewis específica. La combinación de las estructuras de enlace de valencia es el punto principal de la teoría de resonancia. La teoría del enlace de valencia considera que el solapamiento de orbitales atómicos de los átomos participantes formando un enlace químico. Debido al traslape, es más probable que los electrones estén en la región del enlace. La teoría del enlace de valencia considera a los enlaces como orbitales débilmente apareados (traslape pequeño). Típicamente, la teoría del enlace de valencia es más fácil de emplear en moléculas en el estado basal.
7.2. TEORÍA DE LOS ORBITALES MOLECULARES
7.2.1. La teoría de orbitales moleculares fue desarrollada en los años posteriores a que se hubiese establecido la teoría del enlace de valencia (1927), principalmente a través de los esfuerzos de Friedrich Hund, Robert Mulliken, John C. Slater y John Lennard-Jones. Esta teoría se llamó originalmente teoría Hund-Mulliken. La palabra «orbital» fue introducida por Mulliken en 1932. En 1933, la teoría de orbitales moleculares había sido aceptada como una teoría válida y útil. Es un método para determinar el enlace químico en el que los electrones no están asignados a enlaces individuales entre átomos, sino que se mueven bajo la influencia de los núcleos de toda la molécula. En esta teoría, cada molécula tiene un grupo de orbitales moleculares, y se asume que la función de onda ψf del orbital molecular está escrita de manera aproximada como una simple combinación lineal de los n orbitales atómicos constituyentes χi.

