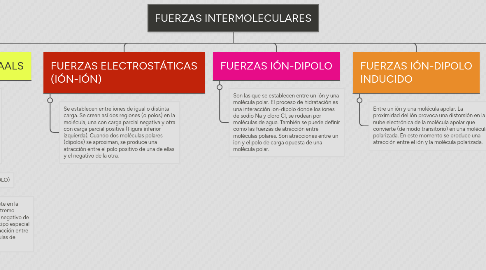
1. FUERZAS DE VAN DER WAALS
1.1. Cuando se encuentran a una distancia moderada, las moléculas se atraen entre sí pero, cuando sus nubes electrónicas empiezan a solaparse, las moléculas se repelen con fuerza. Fuerzas de atracción débiles que se establecen entre moléculas eléctricamente neutras (tanto polares como no polares), pero son muy numerosas y desempeñan un papel fundamental en multitud de procesos biológicos.
1.1.1. FUERZAS DE POLARIDAD (DIPOLO-DIPOLO)
1.1.1.1. La interacción dipolo-dipolo consiste en la atracción electrostática entre el extremo positivo de una molécula polar y el negativo de otra. El enlace de hidrógeno es un tipo especial de interacción dipolo-dipolo. Interacción entre los dipolos eléctricos de las moléculas de cloruro de hidrógeno.
1.1.2. FUERZAS DIPOLO-DIPOLO INDUCIDO
1.1.2.1. Tienen lugar entre una molécula polar y una molécula apolar. En este caso, la carga de una molécula polar provoca una distorsión en la nube electrónica de la molécula apolar y la convierte, de modo transitorio, en un dipolo. En este momento se establece una fuerza de atracción entre las moléculas.
1.1.3. FUERZAS DIPOLO INSTANTÁNEO-DIPOLO INDUCIDO
1.1.3.1. También llamada fuerzas de dispersión o fuerzas de London. Las fuerzas de dispersión son fuerzas atractivas débiles que se establecen fundamentalmente entre sustancias no polares, aunque también están presentes en las sustancias polares. Se deben a las irregularidades que se producen en la nube electrónica de los átomos de las moléculas por efecto de la proximidad mutua. La formación de un dipolo instantáneo en una molécula origina la formación de un dipolo inducido en una molécula vecina de manera que se origina una débil fuerza de atracción entre las dos
