REACCIONES QUIMICAS:
by SaNdii PM
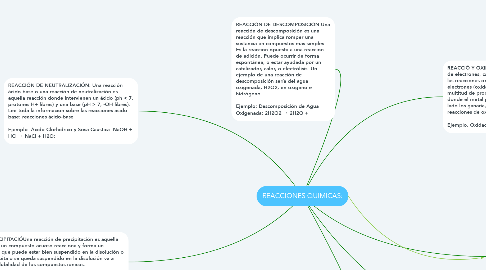
1. REACCIÓN COMBUSTIÓN:Una reacción de combustión consiste en una sustancia reaccionando con oxígeno produciendo energía en forma de luz y calor. Siempre son exotérmicas. Una combustión completa requiere una gran cantidad de oxígeno. Normalmente en las reacciones de combustión la cantidad de oxígeno es limitada, la combustión es por tanto incompleta y se dan diferentes componentes resultantes (cenizas y sales). Cuando un compuesto orgánico combustiona completamente el resultado es siempre agua y dióxido de carbono:Ejemplo. Combustión gas metano: CH4 + 2O2 → 2H2O + CO2
2. REACCIÓN Y PRECIPITACIÓUna reacción de precipitación es aquella reacción en la que un compuesto acuoso reacciona y forma un compuesto sólido, que puede estar bien suspendido en la disolución o precipitar. Si precipita o se queda suspendido en la disolución va a depender de la solubilidad de los compuestos iónicos. Ejemplo: Formación de Sal, cloruro de sodio: 2NaOH(aq) +MgCl2(aq) → 2NaCl(aq) + Mg(OH)2(s)N:
3. REACCIÓN DE NEUTRALIZACIÓN: Una reacción ácido-base o una reacción de neutralización es aquella reacción donde intervienen un ácido (ph < 7, protones H+ libres) y una base (pH > 7, -OH libres). Lee toda la información sobre las reacciones ácido base: reacciones ácido-base Ejemplo. Ácido Clorhídrico y Sosa Cáustica: NaOH + HCl → NaCl + H2O:
4. REACCIÓN DE DESCOMPOSICIÓN:Una reacción de descomposición es una reacción que implica romper una sustancia en compuestos más simples. Es la reacción opuesta a una reacción de adición. Puede ocurrir de forma espontánea, o estar ayudada por un catalizador, calor, o electrólisis. Un ejemplo de una reacción de descomposición sería del agua oxigenada, H2O2, en oxígeno e hidrógeno. Ejemplo: Descomposición de Agua Oxigenada: 2H2O2 → 2H2O +
5. REACCIÓN DE ADICCIÓN:En las reacciones de adición o llamadas reacciones de síntesis, 2 o más elementos se unen para formar 1 solo elemento. Estas reacciones se dan principalmente en química orgánica. La característica principal de estas reacciones es que durante el proceso, el doble o triple enlace se rompe formando nuevos enlaces: Ejemplo: C2H4 + Br2 → C2H4Br2
6. REACCIÓ Y OXIDACIÓN: oxidación-reducción se produce intercambio de electrones, cambiando el estado de oxidación de los elementos. En las reacciones oxidación reducción, uno de los elementos pierde electrones (oxidándose) y otro los gana (reduciéndose) Se dan en multitud de procesos, el más conocido sería el de oxidar un metal, donde el metal pierde 2 electrones, oxidándose. El oxígeno por otro lado los ganaría, reduciéndose. Ver toda la información sobre las reacciones de oxidación-reducción. Ejemplo. Oxidación del hierro: 4Fe + 3O2 + 2H2O → 2Fe2O3.H2O
7. Oswaldo Garcia Espinosa y Sandra Paola Maldonado Martines


