Química
by Luigi Jorge
1. Atomística
1.1. Os átomos são as menores unidades consideradas, mas mesmo assim, em sua composição quando está estável há a presença de subpartículas essenciais, que são: Prótons, que apresentam carga positiva (+1) e massa de 1 Nêutrons, que apresentam carga neutra (0) e massa de 1 Elétrons, que apresentam carga negativa (-1) e massa de 0,0005 (u) é considerado 0
1.2. A (massa) = p (prótons) + n (nêutrons) Z (número atômico) = p (prótons) Íons são átomos que perdem ou ganham elétrons Cátions perdem elétrons (positivo) Ânions ganham elétrons (negativos)
1.3. Os Isótopos são átomos de um mesmo elemento químico que possuem mesmo número atômico
1.4. Os isótonos são átomos que possuem mesmo número de nêutrons
1.5. Isóbaros são átomos de diferentes elementos químicos e, portanto, de diferentes números atômicos, que apresentam o mesmo número de massa
1.6. Os Isoeletrônicos tem o mesmo número de elétrons
2. Radioatividade
2.1. Radiação alfa
2.2. Ocasiona a alteração do núcleo atômico, também chamada de transmutação Formada por dois prótons e dois nêutrons.
2.3. Radiação beta
2.4. A emissão de uma partícula β leva à formação de um novo elemento químico São elétrons, sem massa e possuem carga –1.
2.5. Radiação gama
2.6. Não é formada por partículas Onda eletromagnética Não altera nada na forma do átomo.
2.7. Meia - vida
2.8. O período necessário para que metade da quantidade de uma amostra de determinado radioisótopo sofra decaimento, transformando‑se em outro elemento químico.
2.9. Fissão e fusão nuclear
2.10. Fissão Nuclear É o processo de forçar a divisão de um átomo para formar dois outros, mais leves. Fusão Nuclear É o processo de colidir dois átomos propositalmente para formar um terceiro, mais pesado
3. Modelos Atômicos
3.1. RUTHERFORD
3.2. Núcleo possui os prótons, baixo volume, maior massa e densidade Eletrosferas são imensos espaços vazios entre si contendo os elétrons
3.3. THOMSON
3.4. Átomo maciço, indestrutível e indivisível Átomos iguais com mesma massa Os átomos se relacionam proporcionalmente Modelo Bola de Bilhar
3.5. BOHR
3.6. Os elétrons que giram ao redor do núcleo descrevem órbitas determinadas. O átomo é incrivelmente pequeno, mesmo assim a maior parte do átomo é espaço vazio. Bohr conseguiu prever os comprimentos de onda a partir da constituição do átomo e do salto dos elétrons de uma órbita para a outra.
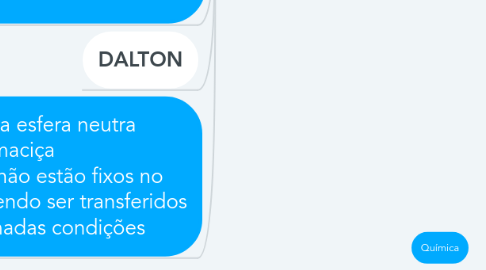
3.7. DALTON
3.8. Átomo é uma esfera neutra porém não maciça Os elétrons não estão fixos no átomo, podendo ser transferidos em determinadas condições


